凝结芽孢杆菌(Bacillus coagulans,以下简称BC01)是一种兼性厌氧、革兰氏阳性、能够形成芽孢的益生菌。近年来,益生菌在肠道与脑功能的双向调节中引起了广泛关注,特别是BC01被发现通过调节肠道微生态,改善腹泻、便秘等消化系统症状,同时在调节中枢神经系统(CNS)中的神经递质,如五羟色胺(5-HT)和多巴胺(DA)方面展现了潜在的作用。本文将深入探讨BC01如何通过调节肠道菌群改善消化功能,并进一步改善注意力、焦虑、抑郁及自闭症等精神疾病症状。
1.肠道菌群与健康的关系
肠道微生物是维持人体消化系统功能和整体健康的重要组成部分。正常情况下,肠道菌群维持在一个动态平衡状态,其中既包含有益菌(如双歧杆菌和乳酸菌),也包含条件致病菌(如大肠杆菌和金黄色葡萄球菌)。这种微生态平衡对维持健康至关重要。然而,当肠道菌群失调时,有害菌的过度生长会引发一系列消化道问题,如腹泻、便秘等。
现代研究发现,肠道菌群失调不仅与消化道疾病有关,还会通过“肠-脑轴”影响大脑功能。肠-脑轴是一种双向通信网络,肠道菌群通过神经、免疫和内分泌途径影响中枢神经系统功能。通过调节肠道菌群,益生菌能够间接影响大脑中的神经递质合成及情绪调节。
2. BC01对肠道菌群的调节作用
BC01作为一种益生菌,具有耐酸耐胆盐的特性,能够有效到达肠道并定殖,调节肠道菌群的平衡。研究表明,BC01具有抑制有害菌(如大肠杆菌、金黄色葡萄球菌)生长的作用【1】。它通过竞争性抑制、产生有机酸及抗菌物质等方式,减少这些致病菌的定植,从而恢复肠道微生态平衡。与此同时,BC01的定殖有助于促进有益菌的增殖,如乳酸菌和双歧杆菌,这些菌群的代谢产物可以进一步维持肠道黏膜的完整性,防止病原体侵入。
在腹泻或便秘等消化系统问题中,肠道菌群失衡通常是一个重要的致病因素。通过减少有害菌的过度增殖,BC01可以帮助恢复正常的肠蠕动,缓解腹泻和便秘【2】。这些改变不仅改善了肠道功能,也为肠-脑轴的正常功能奠定了基础。
中国科学家通过使用功能性便秘小鼠模型,研究了凝结芽孢杆菌BC01(BC01)的通便效果,发现BC01是一种有效缓解便秘不良反应的益生菌菌株,并且高剂量BC01处理对便秘的预防效果最佳。BC01被发现可以增加粪便水分含量,促进肠道蠕动,并改善便秘小鼠小肠的推进率。此外,B. coagulans BC01能够通过调节胃肠道运动、与胃肠道相关蛋白的基因表达、肠道炎症以及肠道微生物群的稳态来改变肠道功能。这些结果表明,益生菌B. coagulans BC01具有预防和治疗便秘的能力【3】。
BC01对小肠组织形态的影响
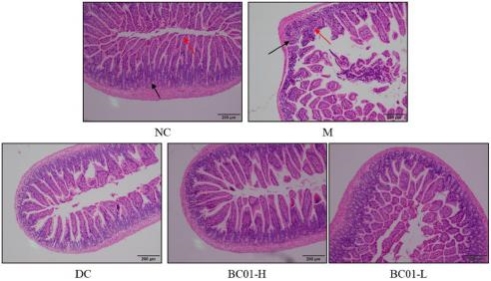
图1
用H&E染色剂染色的小肠组织切片病理学。
NC:正常对照组;
M:便秘模型组;
DC:药物对照组(比沙可啶);
BC01-H:BC01高剂量组;
BC01-L:BC01低剂量组。
显微镜图像显示在图1中,NC组的肠组织结构正常;粘膜层的绒毛长,排列整齐且紧密;数量没有减少,且上皮细胞没有明显退化和脱落,如红色箭头所示;隐窝组织情况较好,如黑色箭头所示。然而,M组的肠组织结构异常。粘膜层某些区域的绒毛数量减少,残余绒毛比NC组短,上皮细胞被侵蚀并脱落,固有层暴露,如红色箭头所示。隐窝数量减少,可以看到炎症细胞和纤维组织增生,如黑色箭头所示。
应用BC01后,无论在高剂量组还是低剂量组,肠组织结构基本正常,粘膜层的绒毛排列整齐且紧密,数量没有减少。上皮细胞没有明显的退化和脱落,组织中没有明显的炎症细胞浸润。BC01高剂量组的小肠组织形态最接近正常对照组。
3.肠道菌群与神经递质的关系
肠道中的某些菌群,尤其是益生菌,能够影响神经递质的合成。五羟色胺(5-HT)和多巴胺(DA)是两种关键的神经递质,在情绪、注意力、动机等心理功能中起重要作用。值得注意的是,约90%的5-HT是在肠道中合成的【4】。BC01通过影响肠道上皮细胞和肠嗜铬细胞的功能,促进5-HT的合成和释放。与此同时,BC01通过抑制肠道中的炎症反应和减少有害菌的代谢毒素,减少肠道对神经递质合成的负面影响【5】。
多巴胺的合成同样受到肠道菌群的影响。研究表明,某些肠道菌群能够通过代谢氨基酸(如酪氨酸和苯丙氨酸)来产生前体分子,这些前体分子可以通过血脑屏障,参与脑内多巴胺的合成【6】。BC01通过调节这些有益菌的生长,从而促进多巴胺的合成,这在改善注意力缺陷和情绪波动方面发挥了重要作用。
4. BC01对精神疾病的潜在改善作用
随着对肠-脑轴研究的深入,越来越多的证据表明,肠道菌群与精神健康密切相关。例如,焦虑、抑郁、多动症(ADHD)和自闭症谱系障碍(ASD)等精神疾病的发病与肠道菌群失调之间存在一定的关联【7】。BC01通过恢复肠道菌群的平衡,能够在一定程度上缓解这些疾病的症状。以下是几种常见精神疾病中BC01的潜在作用机制:
4.1焦虑与抑郁
焦虑和抑郁是两种常见的情绪障碍,神经递质失衡被认为是其核心病理机制之一。肠道菌群通过“肠-脑轴”影响5-HT和DA等神经递质的合成和代谢,从而影响情绪调节。研究表明,BC01能通过以下几种途径改善焦虑和抑郁症状:
- **增加5-HT合成**:BC01促进肠道中的5-HT生成,这种神经递质被称为“幸福激素”,它对缓解抑郁和焦虑有重要作用。通过增强5-HT的合成和释放,BC01有助于改善这些情绪障碍【8】。
- **减少炎症反应**:肠道菌群失调常伴随系统性炎症,炎症因子可通过血脑屏障影响大脑功能。BC01能抑制肠道炎症,降低全身性炎症反应,从而减少对中枢神经系统的负面影响【9】。
4.2注意力缺陷多动障碍(ADHD)
ADHD是一种以注意力不集中、过度活跃和冲动行为为特征的神经发育障碍。多巴胺缺乏被认为是ADHD的重要机制之一【10】。BC01通过调节肠道微生态,促进多巴胺前体物质的产生和代谢,为多巴胺的合成提供足够的原料,从而改善注意力和认知功能【11】。此外,BC01改善肠道健康的同时,减少了由肠道菌群失衡引发的焦虑和情绪波动,这也对ADHD症状的缓解起到了辅助作用。
4.3自闭症谱系障碍(ASD)
ASD是一种复杂的神经发育障碍,其特征包括社交互动障碍、沟通困难和重复性行为。研究发现,自闭症儿童的肠道菌群常常出现显著的失调,肠道问题(如腹泻、便秘)在ASD患者中也非常常见【12】。BC01通过调节肠道微生物,改善消化系统功能,减少肠道菌群紊乱所引发的神经炎症和毒素积累,间接对ASD症状产生积极影响。
此外,研究显示,ASD患者的肠-脑轴功能异常可能通过影响神经递质合成(如5-HT和DA),进一步加重神经发育障碍的症状【13】。BC01通过恢复肠道菌群的正常功能,促进神经递质的平衡,为ASD的潜在治疗提供了新的视角。
5. BC01的应用前景与安全性
尽管BC01在改善肠道健康和精神健康方面展现了广泛的潜力,但其实际应用仍需更多临床试验证实。目前,BC01已作为功能性食品或益生菌补充剂被广泛使用,尤其是在治疗消化系统疾病(如腹泻和便秘)中具有显著效果。由于其天然存在于人体和环境中,并且具有良好的耐酸耐胆盐特性,BC01一般被认为是安全的【14】。
然而,对于患有严重肠道疾病或免疫功能低下的人群,使用BC01时仍需谨慎,最好在专业医生指导下进行。此外,BC01的长期摄入是否存在潜在风险,以及其与其他药物的相互作用也需要进一步研究。
结论
凝结芽孢杆菌BC01通过调节肠道菌群、抑制有害菌生长、促进神经递质合成,展现出改善腹泻、便秘及焦虑、抑郁等情绪障碍的潜力。其通过肠-脑轴对中枢神经系统产生的影响,为治疗ADHD和ASD等神经发育障碍提供了新的方向。然而,虽然BC01的应用前景广泛,仍需更多高质量的临床试验来进一步证实其在精神疾病中的疗效和安全性。
参考文献
1. Lee, H., Ko, G. (2014). Effect of Probiotics on Gut Microbiota: A General Perspective. Korean Journal of Gastroenterology, 63(5), 362-366.
2. Sanders, M. E., Merenstein, D., Reid, G., Gibson, G. R., & Rastall, R. A. (2019). Probiotics andprebiotics in intestinal health and disease: from biology to the clinic. Nature Reviews Gastroenterology & Hepatology, 16(10), 605-616.
3.Zhou X, Chen Y, Ma X, Yu Y, Yu X,Chen X and Suo H (2022) Efficacy of Bacillus coagulans BC01 on loperamide hydrochloride-induced constipation model in Kunming mice. Front. Nutr. 9:964257. doi:10.3389/fnut.2022.964257
4. Yano, J. M., Yu, K., Donaldson, G. P., et al. (2015). Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell, 161(2), 264-276.
5. Lyte, M. (2011). Probiotics function mechanistically as delivery vehicles for neuroactive compounds: Microbial endocrinology in the design and use of probiotics. BioEssays, 33(8), 574-581.
6. Jenkins, T. A., Nguyen, J. C. D., Polglaze, K. E., & Bertrand, P. P. (2016). Influence of tryptophan and serotonin on mood and cognition with a possible role of the gut-brain axis. Nutrients, 8(1), 56.
7. Dinan, T. G., Cryan, J. F. (2017). Gut–brain axis in 2016: Brain–gut–microbiota axis – mood, metabolism and behaviour. Nature Reviews Gastroenterology & Hepatology, 14(2), 69-70.
8. Wang, H., Lee, I. S., Braun, C., & Enck, P. (2016). Effect of probiotics on central nervous system functions in animals and humans: a systematic review. Journal of Neurogastroenterology and Motility, 22(4), 589-605.
9. Heijtz, R. D., Wang, S., Anuar, F., et al. (2011). Normal gut microbiota modulates brain development and behavior. Proceedings of the National Academy of Sciences, 108(7), 3047-3052.
10. Volkow, N. D., Wang, G. J., Kollins, S. H., et al. (2009). Evaluating dopamine reward pathway in ADHD: clinical implications. JAMA, 302(10), 1084-1091.
11. Aarts, E., Ederveen, T. H., Naaijen, J., et al. (2017). Gut microbiome in ADHD and its relation to neural reward anticipation. PloS One, 12(9), e0183509.
12. Luna, R. A., Savidge, T. C., & Williams, K. C. (2017). The brain–gut–microbiome axis: What role does it play in autism spectrum disorder?. Current Developmental Disorders Reports, 4, 59-70.
13. Critchfield, J. W., Van Hemert, S., Ash, M., Mulder, L., & Ashwood, P. (2011). The potential role of probiotics in the management of childhood autism spectrum disorders. Gastroenterology Research and Practice, 2011, 161358.
14. Hong, H. A., Duc, L. H., & Cutting, S. M. (2005). The use of bacterial spore formers as probiotics. FEMS Microbiology Reviews, 29(4), 813-835.

2026-01-29


2026-01-24

2026-01-23

2026-01-21

2026-01-15

2026-01-15

2026-01-12

2026-01-12

2026-01-12

2026-01-29

2026-01-29


2026-01-24

2026-01-23

2026-01-21

2026-01-15

2026-01-15

2026-01-12

2026-01-12
大众健康网 版权所有 @ 2022-2032 客服QQ:183929907
电脑版请访问:http://www.dzjkw.net